Научная концепция метода
Роль субклинического гипопитуитаризма
в патогенезе хронического простатита
ВВЕДЕНИЕ. Клиническая картина хронического простатита (ХП), как известно, во многом определяется снижением либидо и жалобами астенического характера, происхождение которых пока недостаточно изучено. В связи с этим нами было обращено внимание на большое сходство этих жалоб на таковые при разнообразной нейроэндокринной патологии (гипопитуитаризм, синдром "пустого" турецкого седла, соматотропная недостаточность, вторичный гипотиреоз и др.).
МАТЕРИАЛ И МЕТОДЫ. Основу клинического материала составили 271 больной ХП (средний возраст 39,4 лет), находившийся на лечении в центре "Санос" с 2002 по 2005 г.г. В эту группу были включены больные активно высказывавшие жалобы на снижение либидо и ослабление эрекции. На этом фоне у большинства из них наблюдались также в разных сочетаниях жалобы астенического плана (слабость, утомляемость, сонливость, нарушение сна, заторможенность, раздражительность, головные боли при изменении погоды, снижение памяти, зябкость, похолодание конечностей и др.). Всем больным было проведено обследование с участием психиатра, невролога, уролога, эндокринолога, иммунолога, проктолога, ЛОР-врача. Для ультразвуковых исследований (УЗИ) применялся аппарат ALOKA SSD-3500 с цветным допплером, простата исследовалась с помощью ректального датчика (ТРУЗИ), а масса щитовидной железы (ЩЖ) и яичек определялась по стандартной формуле эллипса.
Электроэнцефалограмму (ЭЭГ) регистрировали на компьютерном аппарате NEUROTRAVEL 24D Com по стандартной методике. По неврологическим показаниям 112 больным была назначена магниторезонансная томография (МРТ) головного мозга. Память и ассоциативное мышление пациентов оценивали с помощью психологического теста на опосредованное запоминание [45].
Определение концентраций гормонов сыворотки крови проводилось иммуноферментным методом (ИФА) на фотометре E-LIZA MAT 3000 DRG (США). Использовались высокочувствительные импортные тест-системы (табл. 5). Чтобы облегчить интерпретацию получаемых результатов исследований гормонов (их референтные пределы весьма широки), нами была выведена средняя "условная норма" (табл. 5) для каждого из них (кроме СТГ). Эти величины были получены при исследовании гормонов у больных разного профиля, посетивших центр "Санос". В дальнейшем клинические наблюдения показали, что указанные величины довольно близко соответствуют нормальному гормональному статусу пациентов.
Для оценки иммунитета использовали иммунофенотипический анализ субпопуляций лимфоцитов методом лазерной проточной цитофлюориметрии и с их окраской моноклональными антителами.
Для выявления урогенитальной микрофлоры проводилось лабораторное исследование осадка I порции мочи, секрета простаты, мазков и соскобов из уретры, ПИФ-диагностика и посевы на питательные среды, ПЦР-диагностика.
Статистическая обработка материала проводилась с использованием пакета программ "Статистик-Консультант V3.0 - beta".
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ. По данным урологического исследования у всех больных был диагностирован обструктивный ХП [40] с установлением III-а категории болезни по классификации Национального Института Здоровья США 1995 г. При неврологическом осмотре у больных ХП в большинстве случаев отмечались различные варианты умеренной рассеянной органической симптоматики: высокие сухожильные и периостальные рефлексы с расширением рефлексогенных зон, отсутствие или истощаемость брюшных и кремастерных рефлексов, вегетативные проявления (регионарный гипергидроз, стойкий разлитой дермографизм, лабильность пульса и артериального давления и др.). Результаты МРТ головного мозга отражены в табл. 1.
Таблица № 1
РЕЗУЛЬТАТЫ МРТ ГОЛОВНОГО МОЗГА У БОЛЬНЫХ ХП (N=112)
| Патологические изменения мозга | Число больных | % |
|---|---|---|
| Гидроцефалия, в т.ч. посттравматическая (наружная, внутренняя, наружно-внутренняя): | 61 | 54,4 |
| - с легкой гипертензией | 42 | 68,9 |
| - с умеренной | 13 | 21,3 |
| - с тяжелой | 6 | 9,8 |
| Церебральный конвекситальный или базальный арахноидит | 13 | 11,6 |
| Аденомы гипофиза: | 5 | 4,5 |
| - микроаденомы | 4 | 3,5 |
| - макроаденомы | 1 | 0,9 |
| Кисты: | ||
| - посттравматические | 1 | 0,9 |
| - как следствие ишемического инсульта | 1 | 0,9 |
| Синдром "пустого" турецкого седла | 5 | 4,5 |
| Опухоли | 1 | 0,9 |
| Рассеянный склероз | 1 | 0,9 |
| Синдром Морганьи-Стюарта-Мореля (внутренний лобный гиперостоз) | 4 | 3,5 |
| Платибазия (уплощение основания черепа с увеличением базального угла) | 5 | 4,5 |
| Базиллярная импрессия | 3 | 2,7 |
| Частичный краниостеноз (башенный череп) | 2 | 1,8 |
| Отсутствие изменений | 5 | 4,5 |
ЭЭГ зарегистрирована у 121 больного. Средняя амплитуда и частота основного альфа-ритма в затылочных отведениях демонстрируются табл. 2 и 3.
Таблица № 2
ВАРИАНТЫ СРЕДНЕЙ АМПЛИТУДЫ АЛЬФА-РИТМА В ЗАТЫЛОЧНЫХ ОТВЕДЕНИЯХ У БОЛЬНЫХ ХП (N=121)
| "Плоская" ЭЭГ, до 25 мкв |
Низкоамплитудная ЭЭГ, 26 - 50 мкв |
ЭЭГ с нормальной амплитудой, 51-100 мкв |
Итого |
|---|---|---|---|
| 17 больных (14%) | 60 больных (49,6%) | 44 больных (36,4%) | 121 больной (100%) |
Таблица № 3
ВАРИАНТЫ СРЕДНЕЙ ЧАСТОТЫ АЛЬФА-РИТМА В ЗАТЫЛОЧНЫХ ОТВЕДЕНИЯХ У БОЛЬНЫХ ХП (N=121)
| Замедленный альфа-ритм | 10-герцевыйальфа-ритм | Ускоренный альфа-ритм | Итого |
|---|---|---|---|
| 46 больных (38%) M ± m = 9,14 ± 0,06 Гц |
20 больных (16,5%) M ± m = 10 ± 0,03 Гц |
55 больных (45,5%) M ± m = 11 ± 0,07 Гц |
121 (100%) |
У 100 больных (82,6%) отмечено расхождение средней частоты основного ритма между задним и передним отделами мозга. Генерация альфа-ритма в затылочной области не сопровождалась образованием "веретен". Во всех случаях отмечено нарушение частоты следования альфа-волн - полиритмия.
Результаты измерения латентных периодов (ЛП) зрительных вызванных потенциалов (ЗВП) представлены в табл. 4. Ни у одного пациента не была зарегистрирована нормальная реакция мозга на первую вспышку света при фотостимуляции. При ритмической фотостимуляции у 42 больных (34,7%) наблюдалось отсутствие усвоения ритма на частоте 10 Гц, при этом у 33 из них (78,6%) отмечено усвоение низких частот в диапазоне от 5 до 9 Гц.
Таблица № 4
ДЛИТЕЛЬНОСТЬ ЛП ЗВП В ЗАТЫЛОЧНЫХ ОТВЕДЕНИЯХ У БОЛЬНЫХ ХП
| Длительность ЛП ЗВП, мс | Число больных | % |
|---|---|---|
| 200 - 300 | - | - |
| 301 - 400 | 6 | 5,0 |
| 401 - 500 | 30 | 24,8 |
| 501 - 600 | 32 | 26,4 |
| 601 - 700 | 28 | 23,1 |
| 701 - 800 | 12 | 10,0 |
| 801 - 1000 | 13 | 10,7 |
У 65 больных (53,7%) обнаружены диффузные или генерализованные билатерально-синхронные тета - или дельта-волны (до или после гипервентиляции) или отсутствие альфа-ритма - признаки поражения срединных структур мозга. В 29 случаях (23,9%) зарегистрировано снижение порога судорожной готовности мозга. Наиболее часто встречающиеся варианты ЭЭГ у больных ХП иллюстрируются рис. 1.
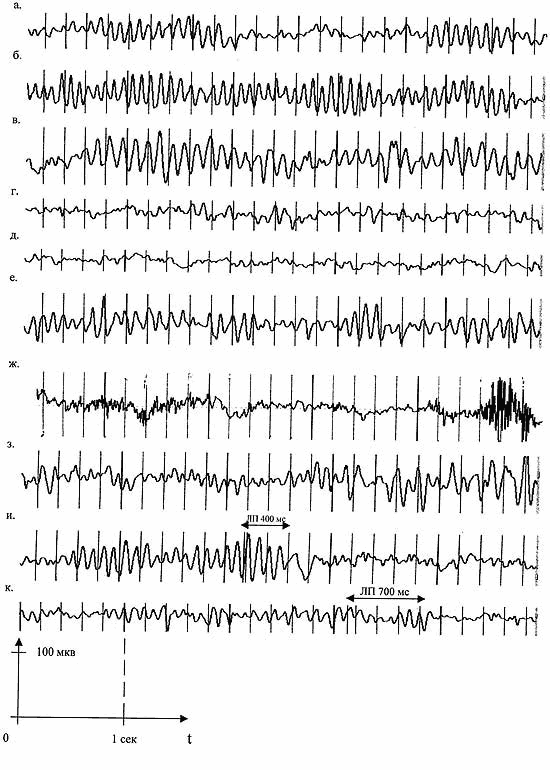
б. ускоренный альфа-ритм при средней частоте 11,4 Гц и амплитуде 75 мкв;
в. замедленный альфа-ритм при средней частоте 8,5 Гц;
г. замедленный низкоамплитудный альфа-ритм при средней частоте 8,7 Гц и амплитуде 23,7 мкв;
д. "плоская" ЭЭГ (отсутствие альфа-ритма);
е. полиритмия (частота альфа-ритма от 6,85 до 13 Гц);
ж. эпилептоидная активность;
з. медленноволновая активность (тета-волны);
и. длительность ЛП ЗВП 400 мс;
к. длительность ЛП ЗВП 700 мс.
Исследование оперативной памяти и ассоциативного мышления методом психологического тестирования у 208 пациентов показало умеренное снижение уровня запоминания в 61 случае (29,3%) и значительное - в 6 (2,9%). Из ведущих психопатологических синдромов отмечены: сенестоипохондрический у 79% больных, депресивный у 50% и бредоподобный у 6%.
Результаты исследования гормонального статуса и распределение концентраций гормонов больных ХП по отношению к их референтным пределам и условной норме отражены соответственно в табл. 5 и 6. Уровень СТГ у 236 больных ХП (87,1%) оказался ниже референтного предела равного 1,0 нг/мл. У 203 больных (74,9%) концентрация в крови АКТГ была ниже условной нормы, в то время как уровень кортизола колебался ниже или выше по отношению к ней практически одинаково (50,5% и 49,5% больных соответственно). Что касается функции щитовидной железы, то у 204 больных (75,3%) уровень Т4 св в крови оказался ниже условной нормы (в среднем на 26%), при этом концентрация ТТГ только в 4,4% случаев превышала референтный предел. В 247 случаях (91,1%) концентрация в крови Тсв была ниже условной нормы, при этом уровень ЛГ превысил референтный предел только у 92 пациентов (33,9%), а Тобщ колебался выше или ниже условной нормы примерно одинаково (54% и 46% соответственно). Корреляционный анализ дал парадоксальные результаты - отсутствие достоверных признаков существующего в норме механизма отрицательной обратной связи между гормонами, являющимися конечными продуктами функционирования эндокринных желез (яичек, щитовидной железы и надпочечников) и управляющими гормонами гипофиза (см. табл. 7).
Таблица № 5
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ГОРМОНАЛЬНОГО СТАТУСА У БОЛЬНЫХ ХП (N = 271)
| Гормоны | Единицы измерения | Чувствительность тест-систем | Референтные пределы | Условная норма | Средние показатели группы больных |
|---|---|---|---|---|---|
| Адренокортикотропный (АКТГ) | пг/мл | 1,2 | 6,0 - 60 | 30,2 ± 1,1 | 24,90 ± 0,70 |
| Тиреотропный (ТТГ) | мкМЕ/мл | 0,03 | 0,4 - 4,2 | 1,7 ± 0,1 | 2,12 ± 0,08 |
| Пролактин(Прл) | нг/мл | 2 | 3,0 - 15,0 | 8,2 ± 0,3 | 8,46 ± 0,29 |
| Соматотропный (СТГ) | нг/мл | 0,5 | 1,0 - 4,0 | - | 0,46 ± 0,06 |
| Лютеонизирующий (ЛГ) | мМЕд/мл | 2 | 1,24 - 7,8 | 5,9 ± 0,2 | 7,18 ± 0,19 |
| Фолликулостимулирующий(ФСГ) | мМЕд/мл | 2 | 1,4 - 15,4 | 5,6 ± 0,3 | 6,63 ± 0,27 |
| Тироксин общий (Т4 общ) | мкг/дл | 0,4 | 5,0 - 13,0 | 8,2 ± 0,2 | 8,34 ± 0,12 |
| Тироксин свободный (Т4 св) | нг/дл | 0,04 | 0,8 - 2,0 | 1,5 ± 0,1 | 1,26 ± 0,02 |
| Трийодтиронин(Т3 св) | пг/мл | 0,05 | 1,8 - 4,2 | 2,9 ± 0,1 | 3,01 ± 0,04 |
| Анти - ТПО | МЕ/мл | 5 | < 50 | < 40 | 5,66 ± 0,93 |
| Тестостерон общий (Т общ) | нг/мл | 0,1 | 2,4 - 12,0 | 5,35 ± 0,1 | 8,32 ± 0,23 |
| Тестостерон свободный(Т св) | пг/мл | 0,19 | 5,0 - 42,0 | 25,0 ± 0,6 | 17,81 ± 0,37 |
| Дигидротестостерон(ДГТ) | пг/мл | 6 | 300 - 850 | 649 ± 14 | 677 ± 13 |
| Эстрадиол (Э) | пг/мл | 4,6 | 10 - 50 | 26,6 ± 1,0 | 31,31 ± 1,17 |
| Кортизол (К) | мкг/дл | 0,1 | 4,0 - 27,0 | 17,5 ± 0,6 | 18,06 ± 0,53 |
| Дигидроэпиандростерон -сульфат(ДГЭ-С) | мкг/мл | 0,05 | 1,0 - 4,2 | 2,52 ± 0,1 | 2,8 ± 0,1 |
Таблица № 6
ОТКЛОНЕНИЯ КОНЦЕНТРАЦИЙ ГОРМОНОВ БОЛЬНЫХ ХП ОТ ИХ РЕФЕРЕНТНЫХ ПРЕДЕЛОВ И УСЛОВНОЙ НОРМЫ (N=271)
| Гормоны | Отклонения концентраций гормонов у больных ХП | |||
|---|---|---|---|---|
| Референтные пределы | Условная норма | |||
| ниже | выше | ниже | выше | |
| АКТГ | 0(0%) | 3(1,1%) | 203(74,9%) | 68(25,1%) |
| ТТГ | 5(1,8%) | 12(4,4%) | 108(39,8%) | 163(60,2%) |
| Прл | 2(0,7%) | 15(5,5%) | 162(59,8%) | 109(40,2%) |
| СТГ | 236(87,1%) | 6(2,2%) | - | - |
| ЛГ | 0(0%) | 92(33,9%) | 107(39,5%) | 164(60,5%) |
| ФСГ | 1(0,4%) | 13(4,8%) | 138(50,9%) | 133(49,1%) |
| Т4 общ | 2(0,7%) | 7(2,6%) | 137(50,5%) | 134(49,5%) |
| Т4 св | 4(1,5%) | 6(2,2%) | 204(75,3%) | 67(24,7%) |
| Т3 св | 2(2,2%) | 9(3,3%) | 132(48,7%) | 139(51,3%) |
| Анти-ТПО | - | 10(3,7%) | - | - |
| Т общ | 1(0,4%) | 13(4,8%) | 147(54%) | 124(46%) |
| Т св | 2(2,2%) | 0(0%) | 247(91,1%) | 24(8,9%) |
| ДГТ | 4(1,5%) | 51(18,8%) | 122(45,0%) | 149(55,0%) |
| Э | 2(2,2%) | 28(10,3%) | 140(51,6%) | 131(48,4%) |
| К | 1(0,4%) | 28(10,3%) | 137(50,5%) | 134(49,5%) |
| ДГЭ-С | 15(5,5%) | 30(11,1%) | 140(51,6%) | 131(48,4%) |
Таблица № 7
ВЗАИМОСВЯЗИ В ГОРМОНАЛЬНОМ СПЕКТРЕ БОЛЬНЫХ ХП (N = 271)
| Взаимосвязи | Коэффициенты корреляции |
|---|---|
| ЛГ - ФСГ | 0,488* |
| Тсв - ДГТ | 0,393* |
| ДГТ - Э | 0,390* |
| Тсв - ДГЭ-С | 0,376* |
| ТТГ - Анти-ТПО | 0,353* |
| ДГТ - ДГЭ-С | 0,309* |
| ФСГ - Тсв | - 0,237 |
| Т4 общ - Т4 св | 0,227 |
| ФСГ - ДГТ | - 0,207 |
Результаты исследования липидного обмена у 348 пациентов отражены в табл. 8. У 16% больных выявлен сахарный диабет II типа различной степени тяжести.
Таблица № 8
ПОВЫШЕНИЕ КОНЦЕНТРАЦИИ В КРОВИ АТЕРОГЕННЫХ ФРАКЦИЙ ЛИПИДОВ У БОЛЬНЫХ ХП В ЗАВИСИМОСТИ ОТ ВОЗРАСТА (N = 348)
| Возраст больных (лет) | Повышение концентрации в крови атерогенных фракций липидов | |
|---|---|---|
| абс | % | |
| 20 - 30 | 16 | 4,6 |
| 31 - 40 | 67 | 19,2 |
| 41 - 50 | 79 | 22,7 |
| 51 - 60 и выше | 65 | 18,7 |
| Итого | 227 | 65,2 |
По данным УЗИ масса ЩЖ в среднем составила 12,1 гр. При этом в 34% случаев она была менее 9 гр. Если учесть, что в норме масса ЩЖ составляет 15 - 20 гр. [14, 19, 28, 39], то у большинства больных ХП имеет место гипоплазия органа. У 50% больных наряду с этим наблюдалась и гипоплазия яичек (масса яичка менее 15 гр.).
Иммунологическое исследование (табл. 9), показало достоверное снижение абсолютного количества Т и В -клеток, Т-хелперов, а также соотношения СD4+/CD+ лимфоцитов крови в основной группе больных ХП. У 91% больных ему сопутствовали воспалительные заболевания других органов и систем (табл. 10). Обнаружена зависимость показателей иммунной системы от распространенности воспалительного процесса (табл. 9). В табл. 11 представлены данные исследования микрофлоры урогенитального тракта у 242 больных ХП, из которой следует, что у большинства из них она была представлена условно-патогенными микроорганизмами, как известно, проявляющими свои агрессивные свойства только в условиях ИДС.
Таблица № 9
ПОКАЗАТЕЛИ ИММУННОГО СТАТУСА У БОЛЬНЫХ ХП ОСНОВНОЙ ГРУППЫ, БЕЗ СОПУТСТВУЮЩИХ (I ГРУППА) И С СОПУТСТВУЮЩИМИ (II ГРУППА) ЗАБОЛЕВАНИЯМИ
| Параметры | Ед. измерен. | Контроль (M ± m) |
Больные простатитом | ||
|---|---|---|---|---|---|
| Основная группа (M ± m) | I группа(M ± m) | II группа(M ± m) | |||
| лейкоциты | 910 cell/l | 6,5 ± 1,24 | 5,89 ± 1,63 | 5,58 ± 1,49 | 5,74 ± 1,40 |
| лимфоциты | %910 cell/l | 28,7 ± 3,7 1,80 ± 0,51 |
31,65 ± 8,54 1,82 ± 0,58 |
32,90 ± 8,40 1,96 ± 0,66 |
31,72 ± 6,0 1,78 ± 0,53 |
| Т-лимфоциты(CD3) | %910 cell/l | 67,8 ± 3,5 1,82 ± 0,21 |
67,03 ± 8,58 1,21 ± 0,41* |
66,27 ± 9,14 1,29 ± 0,44* |
67,42 ± 8,29 1,19 ± 0,41* |
| Т-лимфоциты(CD4) | %910 cell/l | 40,0 ± 4,4 1,05 ± 0,21 |
36,52 ± 7,98 0,66 ± 0,24* |
32,84 ± 7,21 0,64 ± 0,23* |
38,13 ± 7,77 0,68 ± 0,25* |
| Т-лимфоциты(CD8) | %910 cell/l | 28 ± 3,4 0,50 ± 0,14 |
31,78 ± 7,86 0,58 ± 0,24 |
34,87 ± 8,36 0,68 ± 0,27* |
30,41 ± 7,18 0,55 ± 0,14 |
| CD4/CD8 | 1,75 ± 0,21 | 1,24 ± 0,49* | 1,01 ± 0,39* | 1,34 ± 0,49 | |
| В-лимфоциты(CD72) | %910 cell/l | 10,3 ± 1,5 0,28 ± 0,07 |
7,92 ± 3,90 0,15 ± 0,09* |
8,09 ± 4,39 0,27 ± 1,13* |
7,89 ± 3,60 0,14 ± 0,7* |
| NK-клетки(CD16+) | %910 cell/l | 12,0 ± 4,1 0,25 ± 0,06 |
10,70 ± 4,81 0,20 ± 0,14 |
10,70 ± 4,89 0,21 ± 0,13 |
10,70 ± 4,6 0,20 ± 0,14 |
| lg A | g/l | 2,17 ± 0,29 | 2,38 ± 0,93 | 2,51 ± 1,03 | 2,33 ± 0,88 |
| lg G | g/l | 12,06 ± 2,12 | 12,85 ± 2,66 | 13,57 ± 2,46 | 12,57 ± 2,72 |
| lg M | g/l | 1,58 ± 0,42 | 1,48 ± 0,51 | 1,5 ± 0,52 | 1,43 ± 0,9 |
Значком * обозначены больные ХП, имевшие достоверные различия по сравнению с группой здоровых мужчин.
Таблица № 10
СОПУТСТВУЮЩИЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ У БОЛЬНЫХ ХП
| Хронические воспалительные заболевания | Название болезни | Количество больных | % |
|---|---|---|---|
| уха, горла, носа | тонзиллит ринит гайморит другие |
57 18 15 8 |
55,3 |
| дыхания | бронхит другие |
19 10 |
11,8 |
| пищеварения | гастродуоденит холецистит другие |
14 5 5 |
13,5 |
| мочеполовой системы | пиелонефрит цистит другие |
6 2 2 |
5,6 |
| кожи | фурункулез другие |
5 4 |
5 |
| глаз | конъюнктивит блефарит другие |
2 2 1 |
2,25 |
| часто рецидивирующие инфекции | ОРЗ герпес хламидиоз пневмония ангины другие |
58 97 42 21 10 5 |
32,7 54,8 23,7 11,8 5,6 2,8 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ. Особое внимание нами было уделено изучению ЭЭГ, в частности, особенностей альфа-ритма у больных ХП, как надежного индикатора функционального состояния мозга [48]. Этот ритм является основным, отражающим его зрелое, активное состояние. Установлена зависимость психики, памяти и интеллекта от состояния альфа-ритма [31, 46, 49, 58, 61, 63, 65]. По современным представлениям, в его формировании принимают участие базовые таламические водители ритма (пейсмекеры), посылающие синхронные сигналы к коре, в ответ на которые ее многочисленные источники (нейроны) генерируют локальные поверхностные альфа-волны [21, 66]. Зрелость структур головного мозга характеризуется высокой упорядоченностью ЭЭГ [8, 30, 53]. Так, альфа-ритм в норме отличается большим постоянством, его средняя частота составляет около 10 Гц [35, 48]. Согласно полученным нами данным, различного рода нарушения альфа-ритма наблюдались у всех 100% больных. К ним относятся снижение его амплитуды, отсутствие реакции на фотостимуляцию с частотой 10 Гц при усвоении более низких частот, замедление или ускорение частоты, полиритмия, расхождение частоты между задними и передними отделами мозга, отсутствие "ветеренообразования", значительное удлинение ЛП ЗВП. Такая выраженная дезорганизация ЭЭГ может быть следствием незрелости мозга или поражения таламокорковых, стволовых и срединных структур подкорки [8, 16, 17, 30, 35, 38, 54], носящих преимущественно диффузный характер. Сказанное подтверждается результатами неврологического осмотра, а также МРТ (табл. 1) - у большинства больных ХП обнаружены признаки внутричерепной гипертензии и последствий перенесенной нейроинфекции (арахноидиты), т.е. заболеваний, которые обычно оказывают отрицательное влияние на состояние мозга в целом.
Подобная органическая патология мозга может возникать на почве любых острых и хронических инфекций (грипп, энцефалит, менингит, сифилис, туберкулез и т.д.), а также интоксикаций, опухолевых, сосудистых, травматических, генетических и аутоиммунных поражений [1, 3, 15, 32, 34, 41, 51, 60, 69, 70, 71]. Важно отметить, что до 60-80% заболеваний мозга обусловлены многочисленными неблагоприятными факторами в период внутриутробного развития, рождения и в раннем постнатальном онтогенезе [1, 7, 9, 29, 36, 41, 44]. Это может вести к нарушению главного механизма пуберата - активации гипоталамо-гипофизарной оси, контролирующей срок его наступления [57]. На допубератный характер поражения мозга у значительной части больных ХП указывает большая частота выявления у них гипоплазии ЩЖ и яичек. Наличие столь большого числа часто встречающихся факторов, способных вызвать поражение мозга, указывает на вероятность значительной распространенности среди населения данного вида патологии, что и подтверждается результатами нашего исследования.
В свете полученных данных о структурном и функциональном состоянии головного мозга у больных ХП не вызывает удивления обнаруженный нами факт отсутствия достоверных взаимосвязей между функцией гипоталамо-гипофизарного центра и эндокринных желез. Таблица 6 наглядно демонстрирует хаос, царящий в эндокринной системе больных ХП - концентрации гормонов в крови пациентов колеблются в широких пределах, нередко выходя за референтные величины, а гипофиз, как показал корреляционный анализ, не реагирует на указанные изменения. Каждая из указанных систем функционирует как бы в своем режиме, изолированно одна от другой. Дальнейшие исследования позволили нам сделать важное уточнение. У 103 больных из 271 была выявлена тиреоидная недостаточность, протекающая по типу вторичного субклинического гипотиреоза. На фоне заместительной терапии левотироксином в дозе 25 - 100 мкг в сутки во всех случаях наблюдалось снижение уровня ТТГ, что свидетельствует не о полном "выключении" механизма обратной связи между гипофизом и эндокринными органами, а о снижении резервных возможностей указанной системы. То же самое отмечают и другие авторы [33].
В нейроэндокринологии синдромы эндокринной недостаточности с выпадением или снижением функции одного из тропных гормонов гипофиза носит название парциальный гипопитуитаризм, а двух и более - пангипопитуитаризм, которые могут быть первичными (при поражении гипофиза) и вторичными (при поражении гипоталамуса). В нашем случае речь идет преимущественно о пангипопитуитаризме, поскольку чаще всего имеет место снижение концентрации двух и более тропных гормонов гипофиза (табл. 6). Наиболее выраженным оказался дефицит СТГ, АКТГ, тестостерона и тироксина. Таким образом, можно говорить о наличии у больных ХП разных по степени выраженности и сочетаниям соматотропной, тестикулярной, тиреоидной и надпочечниковой недостаточности.
Обнаруженный нами гипопитуитаризм имеет существенное отличие от описанной в классической нейроэндокринологии тяжелой формы болезни, развивающейся при 60 - 95% поражения гипофиза [14, 39]. Оно состоит в том, что у больных ХП уровни тироксина, кортизола и тестостерона чаще всего не падают ниже референтных пределов, а только вплотную приближаются к ним. Адекватная реакция на это со стороны ТТГ, ЛГ, ФСГ и АКТГ обычно отсутствует. Выявление подобных "умеренных", но клинически значимых, проявлений эндокринной недостаточности стало возможным с появлением высокочувствительных тест-систем для ИФА гормонов. Такую форму гипопитуитаризма предлагаем назвать субклинической (по аналогии с субклиническим гипотиреозом).
В этой связи считаем необходимым подвергнуть критике бытующее мнение, что референтные пределы концентраций гормонов в крови являются "нормой" (англ. referent - то, с чем соотносится знак). Как известно, уровень гормонов подвержен выраженным суточным, месячным и сезонным колебаниям и, кроме того, имеет индивидуальные генетические, половые и возрастные особенности. Поэтому, при оценке результатов исследования необходимо учитывать не только концентрацию гормонов, но и всю совокупность клинических данных. В ряде случаев требуется проведение повторных исследований гормонального статуса. Следует также помнить, что даже малейший дефицит некоторых гормонов, например, тироксина, может иметь необратимые последствия для организма, особенно, для ЦНС [7, 10, 14, 22, 43].
Поскольку внимание больных ХП сконцентрировано на состоянии сексуальной сферы, то они обычно не высказывают активно жалоб астенического характера. Однако, как показали наши наблюдения, именно астения часто является ведущим синдромом в клинической картине данного заболевания, а снижение либидо относится только к одному, хотя и очень важному, из ее проявлений.
Все это требует более тщательного выявления жалоб больных и изучения анамнеза болезни (по возможности, начиная с периода внутриутробного развития). Исследование гормонов должно проводиться с применением высокочувствительных тест-систем, позволяющих работать в диапазоне референтных величин. Неврологическое обследование должно быть углубленным, с использованием современных методов диагностики (ЭЭГ, МРТ, РЭГ, допплерография, позитронно-эмиссионная томография и т.д.).
Относится ли выявленный нами гипопитуитаризм к первичному, вторичному или смешанному по форме нам установить не удалось, т.к. для этого требуется проведение специальных проб. Однако, по мнению нейроэндокринологов, данный вопрос не имеет большого практического значения, поскольку лечение любых форм гипопитуитаризма в настоящее время заключается, в основном, в назначении заместительной терапии гормонами по соответствующим показаниям [4, 34, 57, 59, 64, 67].
Одним из самых серьезных последствий нейроэндокринной недостаточности является развитие стойкого вторичного ИДС [5, 6, 7, 11, 17, 23, 25, 62], которое, собственно, и является причиной присоединения инфекции и возникновения ХП, а также воспалительных заболеваний других органов. Наличие ИДС у больных ХП подтверждается тремя основными признаками: 1) изменениями клеточного иммунитета; 2) наличием хронического инфекционного процесса в простате и других органах; 3) наличием инфекционного заболевания, вызванного условно-патогенной флорой (табл. 9 - 11).
Таблица № 11
ДАННЫЕ МИКРОБИОЛОГИЧЕСКОГО АНАЛИЗА У БОЛЬНЫХ ХП (N = 242)
| Выявленная флора | Количество больных | % |
|---|---|---|
| стафилококк | 104 | 42,9 |
| хламидия | 65 | 26,8 |
| микоплазма | 30 | 12,3 |
| анаэробная флора | 28 | 11,5 |
| стрептококк | 22 | 9,0 |
| энтерококк | 17 | 7,0 |
| кишечная палочка | 14 | 5,7 |
| уреаплазма | 11 | 4,5 |
| вирус герпеса II | 10 | 4,1 |
| трихомонада | 10 | 4,1 |
| нейссерия | 5 | 2,0 |
| гарднарелла | 5 | 2,0 |
| грибы | 4 | 1,6 |
| гонококк | 2 | 0,8 |
Механизм нейроэндокринноиммунного взаимодействия изучен недостаточно, однако установлено, что в норме иммуноциты, продуцируя местные и системные нейропептиды и иммунотрансмиттеры информируют о возникших локальных повреждениях головной мозг, который мобилизует организм к защите, путем активации вегетативной нервной и эндокринной систем [2, 26] . Ведущая роль здесь принадлежит гипоталамусу - высшему вегетативному центру, регулирующему все виды обмена (белковый, углеводный, жировой, водный, минеральный, основной обмен), тканевое дыхание. Эти функции, в основном, опосредуются через гормоны [27, 29, 37, 42, 47].
Установлено, что большинство из известных гормонов обладают иммуномодулирующим действием. К ним относятся СТГ, ТТГ, АКТГ, ФСГ, тироксин, глюкокортикоиды, половые гормоны, вазопрессин, окситоцин, мелатонин [2], т.е. практически почти все гормоны о которых идет речь в данной работе. К отделам мозга, участвующим в регуляции функции иммунной системы кроме гипоталамо-гипофизного центра относят и другие подкорковые (срединные) структуры [11], а также кору [50], которые по данным полученным нами при ЭЭГ часто поражаются у больных ХП.
Следовательно, первичное органическое поражение мозга у больных ХП является причиной не только эндокринной недостаточности, но и неадекватного иммунного ответа. С другой стороны, поскольку иммуномодулирующее действие гормонов связано, в основном, с их участием в регуляции указанных выше обменных процессов, то их недостаток может вести не только к ИДС, но и дистрофическим и функциональным изменениям в периферических органах, что и создает предпосылки для развития в них хронической инфекции. Наиболее тяжелы последствия тиреоидной и, особенно, соматотропной недостаточности, которые могут приводить даже к атрофии (спланхномикрии) органов [39] и вторичным тяжелым поражениям ЦНС [7, 27, 44, 47].
Этот своеобразный "порочный" круг как раз и объясняет происхождение у больных психических расстройств, снижения памяти и интеллекта, жалоб сексуального и астенического плана, а также всю сложность проблем диагностики и лечения ХП, предлагаемая схема патогенеза которого представлена в табл. 12.
Таблица № 12
ЦЕНТРАЛЬНЫЕ МЕХАНИЗМЫ ПАТОГЕНЕЗА ХРОНИЧЕСКОГО ПРОСТАТИТА
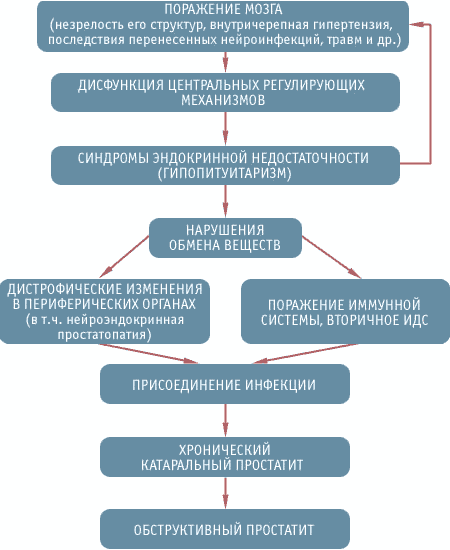
ЗАКЛЮЧЕНИЕ. Таким образом, в основе патогенеза ХП чаще всего лежит нейроэндокринноиммунная патология, в форме субклинического гипопитуитаризма.
На фоне поражения мозга и снижения резервных возможностей гипоталамо-гипофизарного центра у больных возникает различная по степени выраженности и сочетаниям соматотропная, тиреоидная, тестикулярная и надпочечниковая недостаточность, которая усугубляет состояние центральной нервной и эндокринной систем, а также ведет к дистрофическим и функциональным изменениям в периферических органах и развитию ИДС. В простате на этой почве возникают застойные явления в форме нейроэндокринной простатопатии ("застойная простата", "простатоз", "простатодиния"). По мере прогрессирования ИДС присоединяется инфекция, которая вначале носит характер хронического катарального воспаления, а затем переходит в обструктивную фазу [40].
Развернутая картина болезни сопровождается соответствующими психическими, мнестическими и сексуальными расстройствами, а также астенизацией организма, которые обусловлены, в основном, состоянием ЦНС и эндокринной недостаточностью. Кроме того, больные ХП являются группой риска развития раннего атеросклероза и сахарного диабета со всеми вытекающими отсюда последствиями.
Ставка на антибактериальную терапию на таком фоне, как показал опыт последних нескольких десятилетий ее применения при ХП, оказалась несостоятельной. Совершенно очевидно, что лечебную тактику следует существенно изменить. Исходя из патогенеза ХП схематично это видится нами так: лечебные мероприятия должны быть направлены в первую очередь на восстановление (улучшение) функции головного мозга, коррекцию гормональных нарушений, всех видов обмена и связанного с ними ИДС. Значительная роль здесь принадлежит заместительной терапии соответствующими гормонами, показания к которой, конечно, должны быть строго обоснованы. Начинать ее необходимо именно на субклинической стадии болезни, до развития в органах необратимых изменений [14]. В этом и состоит главный смысл ранней диагностики гипопитуитаризма.
Параллельно должно проводиться дренирование очагов инфекции в простате и выявление скрытой в них микрофлоры [13], а также, при необходимости, санация других органов. Антибиотики применяются только при выявлении патогенной микрофлоры или обострении инфекции, имеющего клинико-лабораторное подтверждение [12]. Первый опыт применения такой технологии в нашем центре дал обнадеживающие результаты.
/А.Р. Гуськов/
Список литературы:
- Артюкова О.В. Гипоталамический синдром пубертатного периода. Автореф. дисс. канд. мед. наук. М., 1997. с. 30.
- Арцимович Н.Г. и др. Нарушения иммунитета как результат нейрогормональных расстройств. Матер. 2-го съезда иммунологов России, 6 - 10 сентября 1999 г. Тез. докладов. Сочи, 1999. с. 309-312.
- Бабурина М.Б. Синдром "пустого" турецкого седла. Проблемы эндокринологии. 1999. т. 45. № 3. с. 42-47.
- Балаболкин М.И. и др. Дифференциальная диагностика и лечение эндокринных заболеваний (Руководство). М., "Медицина". 2002. с. 751.
- Баранов А.А. Медико-социальные последствия йододефицитных состояний. Профилактика и лечение. Пособие для врачей. М. - Пермь, 1999. с. 43.
- Бахметьев Б.А., Лихачева Н.С. Влияние соматотропного гормона на функцию фагоцитирующих клеток крови человека. Проблемы эндокринологии. 2000. т.46. № 3. с. 25-28.
- Бутова Е.А. и др. Йододефицитные заболевания и беременность. Российский вестник акушера-гинеколога. 2004. № 1. с. 12-17.
- Веденеева Л.С. Формирование временной организации электроэнцефалограммы детей школьного возраста. Автореф. дисс. канд. биол. наук. СПб. 1998. с. 23.
- Воронцов А.В. Магнитно-резонансная томография в диагностике патологии гипоталамо- гипофизарной системы и надпочечников. Автореф. дисс. докт. мед. наук. М., 2001. с. 40.
- Голдырева Т.Г. и др. Особенности психического статуса у больных йододефицитным зобом. Клиническая медицина. 2000. № 3. с. 32-35.
- Гончарова Н.Д. и др. Возрастные нарушения эндокринных функций и возможные пути их коррекции. Бюллетень экспериментальной биологии и медицины. 2002. т. 134. № 11. С. 484-489.
- Горлина Н.К. и др. Комплексное лечение хронического обструктивного простатита, осложненного вторичным иммунодефицитом. Пособие для врачей. М., 2005. с. 48.
- Гуськов А.Р. Сравнительный анализ эффективности различных технологий дренирования предстательной железы у больных хроническим обструкивным простатитом. Урология. 2001. № 6, с. 9-12.
- Дедов И.И. и др. Эндокринология. М., 2000. "Медицина". с. 631.
- Дедов И.И. и др. Соматотропная недостаточность. М., Индекс Принт. 1998. с. 302.
- Докукина Т.В. и др. Дифференциально-диагностическое значение нарушений частотно-пространственной структуры альфа-ритма у больных неврозами. Проблемы психиатрии в Республике Беларусь: Материалы конференции, посвященной 70-летию каф. психиатрии Минского гос. мед. ин-та, 5 декабря 1995 г. Минск. 1995. с. 198-199.
- Железникова Г.Ф.и др. Роль кортизола, пролактина и гормона роста в регуляции иммунного статуса у детей переносящих острые респираторно-вирусные инфекции. Педиатрия. 2001. № 1. с. 99-100.
- Жестикова М.Г. и др. Компрессионно-спектральный анализ ЭЭГ в оценке межполушарной ассиметрии у больных с гипоталамогипофизными нарушениями. Новые направления в клинической медицине: Всеросс. конф., 15-16 июня 2000 г. Материалы. Ленинск- Кузнецкий. 2000. с. 255-256.
- Зайратьянц О.В. Эпидемиология и этиологическая структура узлового зоба по данным аутопсий. Матер. 2-го Всероссийского тиреоидологического когресса: "Актуальные проблемы заболеваний щитовидной железы", 20-21 ноября 2002 г. М., 2002. с. 50-60.
- Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. Руководство для врачей. М., "Медицина". 1991. с. 640.
- Исайчев С.А. и др. Генераторы ритмической альфа-активности ЭЭГ человека. Журн. высшей нервной деятельности им. И.П. Павлова. 1999. т. 49. № 6, с. 919-925.
- Касаткина Э.П. Современные аспекты роста и развития детей (эндокринная регуляция). Педиатрия. 1995. № 4. с. 33-36.
- Клюшник Т.П. и др. Клинико-иммунологические взаимосвязи при перинатальных поражениях ЦНС. Матер. международного конгресса "Иммунитет и болезни: от теории к терапии", 3-8 октября 2000 г. М., 2005. с. 149-150.
- Князев В.И. Клинико-иммунологические особенности у детей дошкольного возраста с диффузным увеличением щитовидной железы в условиях крупного промышленного города. Дисс. канд. мед. наук. Воронеж. 1996. с. 131.
- Коваленко Т.В. Здоровье и развитие детей, рожденных в условиях зобной эндемии. Автореф. дисс. докт. мед. наук. Ижевск. 2000. с. 49.
- Корнева Е.А. Современные аспекты изучения проблемы нейроиммуномодуляции. Матер. 2-го съезда иммунологов России 6-10 сентября 1999 г. Тез. докладов. Сочи. 1999. с. 305-308.
- Курляндская Р.М. и др. Возможности медикаментозной коррекции недостатка гормона роста у взрослых. Лечащий врач. 2001. № 9. с. 4-8.
- Кэттайл В.М., Аркин Р.А. Патофизиология эндокринной системы. (Перевод с англ., под ред. Ю.В. Наточина). М., 2001. "Бином". с. 335.
- Логачев М.Ф. Задержка внутриутробного развития и постнатальная низкорослость у детей: этиология, патогенез, клиническая картина, диагноз. Автореф. дисс. докт. мед. наук. М., 2000. с. 44.
- Лукашевич И.П. и др. Исследование нейрофизиологических механизмов задержки психического развития у детей. Структурный анализ ЭЭГ. Физиология человека. 1998. Т. 24. № 1. с. 16-20.
- Мальцева И.В., Маслобоев Ю.П. Параметры альфа-ритма и продуктивность запоминания. Физиология человека. 1996. Т. 12. № 3. с. 11-17.
- Мельниченко Г.А. и др. В помощь больным с гипоталамо-гипофизарными расстройствами (школа больного). Проблемы эндокринологии. 1996. Т. 42. № 5. с . 32-33.
- Нагаева Е.В. и др. Вторичный гипотиреоз: особенности диагностики и лечения. Проблемы эндокринологии. 2002. Т. 48. № 6. с . 26-30.
- Нейроэндокринология. Клинические очерки. (Под ред. Е.И. Маровой). Ярославль. "Диа-пресс". 1999. с. 505.
- Пальчик А.Б. Эволюционная неврология. (Краткое руководство). СПб. 2002. "Питер". с. 383.
- Пальчик А.Б., Чугреев И.В. Диагностика перинатальных поражений мозга у новорожденных методом электроэнцефалографического картирования. Педиатрия. 1995. № 3. с. 11-15.
- Петеркова В.А., Волеводз Н.Н. Современная диагностика и лечение соматотропной недостаточности. Современные концепции клинической эндокринологии: Материалы 1-го Московского съезда эндокринологов, 14-16 апреля 1997 г., М., 1997. с. 214-220.
- Рожков В.П., Сороко С.И. Формирование взаимодействия между волновыми компонентами основных ритмов ЭЭГ у детей первых пяти лет жизни. Физиология человека. 2000. Т. 26. № 6. с. 5-19.
- Руководство по клинической эндокринологии. (Под ред. Н.Т. Старковой). СПб. 1996. "Питер Пресс". с. 540.
- Степанов В.Н., Гуськов А.Р. Хронический обструктивный простатит. Урология. 2001. № 1. с. 22-27.
- Суворинова Н.Ю. Лечение ноотропными препаратами детей с минимальными мозговыми дисфункциями. Дисс. канд. мед. наук. М., 1998. с. 116.
- Сыч Ю.П. и др. Нарушение липидного обмена при субклиническом гипотиреозе. Проблемы эндокринологии. 2004. Т. 50. № 3. с. 48-51.
- Терещенко И.В. Субклинический гипотиреоз и его маски у лиц пожилого и старческого возраста. Труды VI Российского национального конгресса "Человек и лекарство", 19-23 апреля 1999 г. М., 1999. с. 400-409.
- Титченко Л.И. и др. Перинатальные аспекты беременности, осложненной заболеваниями щитовидной железы. Российский вестник акушера-гинеколога. 2004. № 1.
- Тихомиров Л.Ф. Развитие интеллектуальных способностей школьника. Ярославль: Академия развития. 1997. с. 247.
- Трауготт Н.Н. О механизмах нарушения памяти. Л.: Наука, 1973. с. 133.
- Фадеев В.В. Современные концепции диагностики и лечения гипотиреоза у взрослых. Проблемы эндокринологии. 2004. Т. 50. № 2. с. 47-53.
- Фарбер Д.А., Вильзавский В.Ю. Гетерогенность и возрастная динамика альфа-ритма энцефалограммы. Физиология человека. 1996. Т. 22. № 5. с. 5-12.
- Фарбер Д.А. и др. Структурно-функциональная организация развивающегося мозга. Л.: Наука, 1990. с. 198.
- Фокин В.Ф., Понамарева Н.В. Энергетическая физиология мозга. "Атидор". М., 2003. с.288.
- Фофанова О.В. и др. Соматотропная недостаточность у детей и антигипофизарные антитела как показатели аутоиммунитета у пациентов и их родителей. Проблемы эндокринологии. 1996. Т. 42. № 3. с. 10-15.
- Френкель Г.М. Электрическая активность головного мозга при эндокринных нарушениях и ее возрастные особенности. М., 1994. с. 360.
- Цицерошин М.Н. Отражение системной деятельности мозга в пространственной структуре ЭЭГ у взрослых и детей. Автореф. дисс. докт. мед. наук. СПб. 1997. с. 37.
- Чантурия М.Д. Клинико-лабораторные особенности больных неврозом, страдающих сексуальными расстройствами. Мед. новости Грузии. 2001. № 6. с. 31-33.
- Черешнев В.А. Иммунные механизмы воспаления. Матер. Международного конгресса "Иммунитет и болезни: от теории к терапии", 3-8 октября 2005 г. М., 2005. с. 154-155.
- Щеплягина Л.А. и др. Йод и интеллектуальное развитие ребенка. Русский медицинский журнал. 2002. Т 10. № 7. с. 358-363.
- Эндокринология. (Под. ред. Н. Лавина). Перевод с англ. М., Практика. 1999. с. 1128.
- Angelakis E. et al. Electroencephalografic peak alpha frequency correlates of cognitive traits. Neurosci. Lett. 2004. Nov.16; 371 (1): 60-63.
- Bilger M. et al. Androgen replacement in adolescents and young women with hypopituitarism. J. Pediatr. Endocrinol. Metab. 2005. Apr; 18(4): 355-362.
- Canley K. et al. Lymphocytic hypophysitis. Conn. Med. 2005. Mar; 69 (3): 143-146.
- Giannitrapani D. The Electrophysiology of intellectual function. Basel: Karger, 1985. P. 247.
- Glinoer D. Material and neonatal thyroid function in mild iodine deficiency. In: The thyroid and iodine. Stuttgard - New York. 1996; 129-143.
- Hanslmayr S. et al. Increasing individual upper alpha power by neurofeed back improves cognitive performance in human subjects. Appl. Psychophysiol. Biofeedback. 2005. Mar; 30 (1): 1-10.
- Hashimoto K. Diagnosis and treatment of hypopituitarism. Nippon Naika Gakkai Zasshi. 2005. Mar. 10; 94 (3): 479-484. Review.
- Herrmann C.S. et al. Phase-locking and amplitude modulations of EEG alpha: Two measures reffect different cognitive processes in a working memory task. Exper. Psychol. 2004; 51 (4): 311-318.
- Hughes S.W., Crunelli V. Thalamic mechanisms of EEG alpha rhythms and their pathological implications. Neuroscientist. 2005, Aug; 11 (4): 357-372.
- Kann P.H. Growth hormon therapy in adults. Internist (Berl.). 2005. Jun 1.
- Klimesch N. et al. Alpha frequency and memory performance. J. Psychophysiology. 1990. V. 4. N 4. P. 381.
- Pekis S. et al. Hipopituitarism as a late complication of hemorragic fever. Endocrine. 2005. Mar; 26 (2): 79-82.
- Popovic V. et al. Hypopituitarism following traumatic brain injury. Growth Horm. IGF Res. 2005 Jun; 15 (3): 177-184.
- Rao N., Thomas N. Short stature. Congenital panhypopituitarism. I. Assoc. Physicans India. 2004. Aug; 52: 630.
